近日,金沙9001w以诚为本入口第二医院检验医学中心郭海洋研究员团队在Journal of Experimental Medicine杂志(中科院一区,IF=11.743)在线发表了题为“Uncovering the dosage-dependent roles of Arid1a in gastric tumorigenesis for combinatorial drug therapy”的研究论文,揭示了染色质重塑蛋白Arid1a缺失介导的基因组表观修饰改变对胃癌发生发展的影响。该论文是金沙9001w以诚为本入口第二医院检验医学中心与多伦多大学病童医院Tae-Hee Kim团队合作完成,Tae-Hee Kim教授和郭海洋研究员为共同通讯作者。
据悉,世界范围内,胃癌是第三大致死性恶性肿瘤,每年造成的死亡人数约占所有肿瘤死亡人数的8%左右。胃癌基因组的一个显著特征是染色质修饰基因的高突变率,例如BAF染色质重塑复合体成员ARID1A和ARID1B在胃癌中的突变率分别为14–31%和9%。BAF复合体通过ATP依赖的方式动员核小体并广泛改变基因组的组蛋白修饰,其成员的突变在多种肿瘤的发生中发挥重要作用。在胃癌中,最近的临床研究发现ARID1A的缺失与病人较差的预后和淋巴结转移相关,一些细胞模型中的研究也显示ARID1A的低表达能够促进胃癌细胞的生长和迁移。但ARID1A在动物体内模型的胃癌发生中的作用和具体机制仍不清楚。
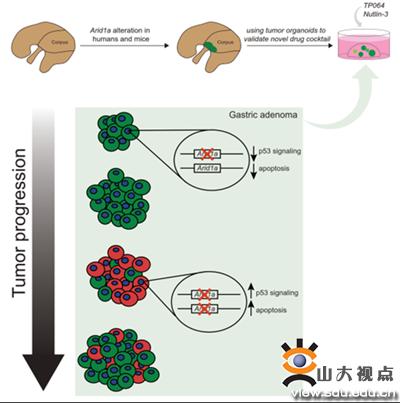
郭海洋团队在Notch信号活化的胃癌发生小鼠模型(Atp4bCre;Rosa26NICD)的基础之上,进一步构建了ARID1A基因杂合缺失(Atp4bCre;Rosa26NICD;Arid1aflox/+)和纯合缺失(Atp4bCre;Rosa26NICD;Arid1aflox/flox)的小鼠模型。相较于ARID1A基因完整的胃癌,ARID1A杂合缺失的胃癌具有更强的增殖能力。但出乎意料的是,ARID1A基因纯合缺失的胃癌恶性程度指标却显著低于ARID1A基因杂合缺失的胃癌。免疫荧光染色显示,尽管对ARID1A基因纯合敲除在早期显示了很高的效率,但随时间推移ARID1A阳性胃癌细胞通过增值优势逐渐取代了ARID1A阴性胃癌细胞。为探究ARID1A基因在胃癌发生中剂量依赖效应的机制,团队对小鼠正常胃组织、ARID1A基因完整性胃癌、ARID1A基因杂合缺失胃癌和ARID1A基因纯合缺失早期的胃癌分别进行了RNA-Seq、H3K27ac和H3K4me3 ChIP-Seq实验,并对Atp4bCre;Rosa26NICD;Arid1aflox/flox胃癌组织进行了单细胞RNA-Seq测序。整合分析和体内验证发现,ARID1A基因的杂合缺失导致胃癌基因组发生了广泛的H3K27ac修饰丢失,这种丢失富集于重要抑癌通路TP53途径和细胞凋亡途径基因的增强子区域,从而导致ARID1A杂合缺失胃癌中细胞凋亡相关基因表达被抑制和晚期凋亡率的显著下降。而在ARID1A纯合缺失的胃癌中,部分TP53/凋亡相关基因的增强子区域重新获得H3K27ac修饰,导致其细胞凋亡比率相比杂合缺失胃癌上升。
基于ARID1A纯和缺失降低了胃癌细胞适应性这一发现,团队提出深度抑制BAF复合物活性能够有效杀伤含有部分ARID1A表达的胃癌,并验证了BAF复合物抑制剂TP064对ARID1A杂合缺失胃癌类器官的杀伤作用。进而基于ARID1A杂合缺失的胃癌中TP53途径受到抑制这一发现,团队提出激活TP53通路活性能够进一步杀伤ARID1A杂合缺失的胃癌,并证实了联合应用TP064和TP53激动剂Nutlin-3处理对ARID1A杂合缺失的胃癌类器官具有显著的协同杀伤效应。
本研究不仅阐明了ARID1A在胃癌发生中独特的剂量依赖效应,而且揭示了ARID1A杂合缺失胃癌的脆弱性所在,对其应用抑制BAF复合物和激活TP53途径的联合疗法具有重要的潜在临床价值。本研究论文研究工作得到了科技部重点研发计划和山东省泰山学者工程等项目的资助。
郭海洋研究员团队长期致力肿瘤表观基因组学的研究,系统分析和验证了一系列与前列腺癌发生风险相关的长链非编码RNA,并揭示了转录因子ONECUT2、SOX2等在前列腺癌和胃癌发生发展中的表观遗传学作用机制。相关研究性工作以第一/通讯作者身份发表于Nature Genetics(2016)、Nature Communications(2019)、Science Advances(2019)等期刊。
论文链接:
https://rupress.org/jem/article-abstract/218/6/e20200219/211950/Uncovering-the-dosage-dependent-roles-of-Arid1a-in?redirectedFrom=fulltext