近日,基础医学院高成江教授团队在Autophagy杂志(中科院1区,IF:16.02)在线发表以“USP5 attenuates NLRP3 inflammasome activation by promoting autophagic degradation of NLRP3”为题的研究成果。金沙9001w以诚为本入口基础医学院博士研究生蔡宝珊、赵健为该论文的共同第一作者,金沙9001w以诚为本入口基础医学院高成江教授、金沙9001w以诚为本入口基础医学院助理研究员刘冰玉为该论文的共同通讯作者,金沙9001w以诚为本入口为第一作者单位和唯一通讯作者单位。
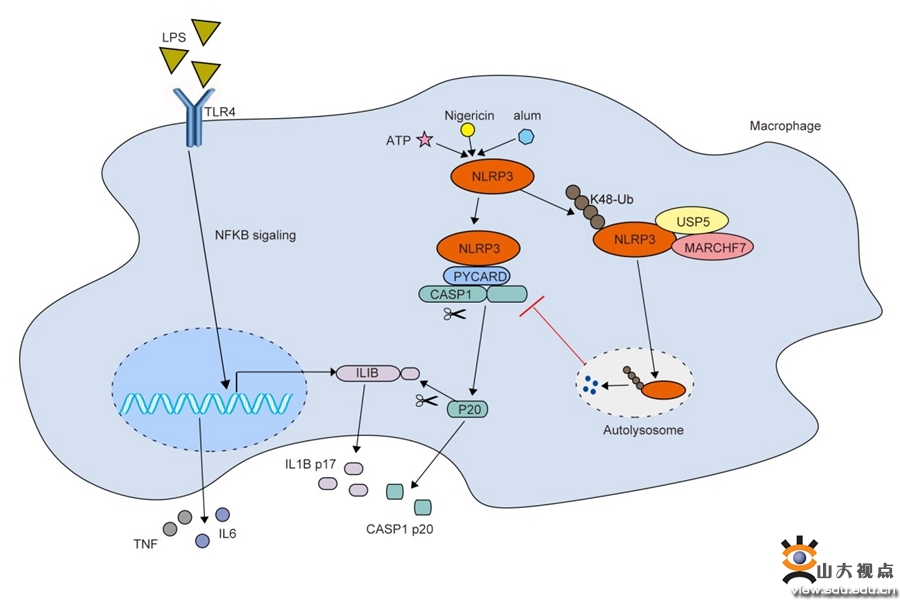
NLRP3炎症小体在宿主防御微生物病原体方面具有重要作用。NLRP3表达水平的增加是炎症小体激活的关键步骤,适度的NLRP3表达可以帮助机体抵抗外源性微生物感染和内源性细胞损伤。但是,NLRP3蛋白的过度积累也会引发某些遗传性或急性炎症性疾病,如痛风、动脉粥样硬化和炎症性肠病。因此NLRP3的表达必须受到严格调控,防止其过度活化导致炎症性疾病的发生。已有研究表明,炎症小体激活后,NLRP3可存在于自噬体和溶酶体中且NLRP3可通过自噬途径降解。然而,目前调控NLRP3自噬降解的机制尚不清楚。
USP5是USP去泛素化酶家族的一员,本研究通过软件预测和蛋白共定位分析,发现USP5定位于溶酶体/自噬体,进一步证实USP5在NLRP3炎症小体激活过程中发挥着关键的调控作用,过表达USP5抑制了LPS和ATP触发的IL-1β的产生,减轻了明矾诱导的腹膜炎。深入的机制研究发现USP5作为支架蛋白,可以招募E3泛素连接酶MARCH7,选择性促进NLRP3 K48链接的多聚泛素化修饰,并介导NLRP3进入自噬降解途径,促进NLRP3蛋白的降解,从而抑制炎症小体的激活。本研究在NLRP3炎症小体的过度激活和炎症性天然免疫反应的调控机制方面提供了新的见解,并为相关疾病治疗和预防提供了新的潜在治疗靶点。
高成江教授团队长期致力于天然免疫信号转导的调控机制研究,系统探索抗病毒天然免疫信号转导以及炎症反应的调控机制,相关研究成果相继发表在Nature Immunology,Signal Transduction and Targeted Therapy,Advanced Science,Journal of Experimental Medicine,Nature Communications,Cell Death & Differentiation,PLOS Pathogens等国际权威杂志上。上述研究得到金沙9001w以诚为本入口攀登计划创新群体项目、国家自然科学基金重点项目、全国博士后创新人才计划等项目资助。
原文链接:https://doi.org/10.1080/15548627.2021.1965426