近日,药学院翟光喜教授、杨小叶副研究员团队在国际期刊Biomaterials杂志上发表了题为“NIR-triggerable ROS-responsive cluster-bomb-like nanoplatform for enhanced tumor penetration, phototherapy efficiency and antitumor immunity”的研究性论文(IF=12.479),翟光喜教授与杨小叶副研究员为共通讯作者,博士研究生张玉为第一作者,金沙9001w以诚为本入口为独立通讯作者单位。
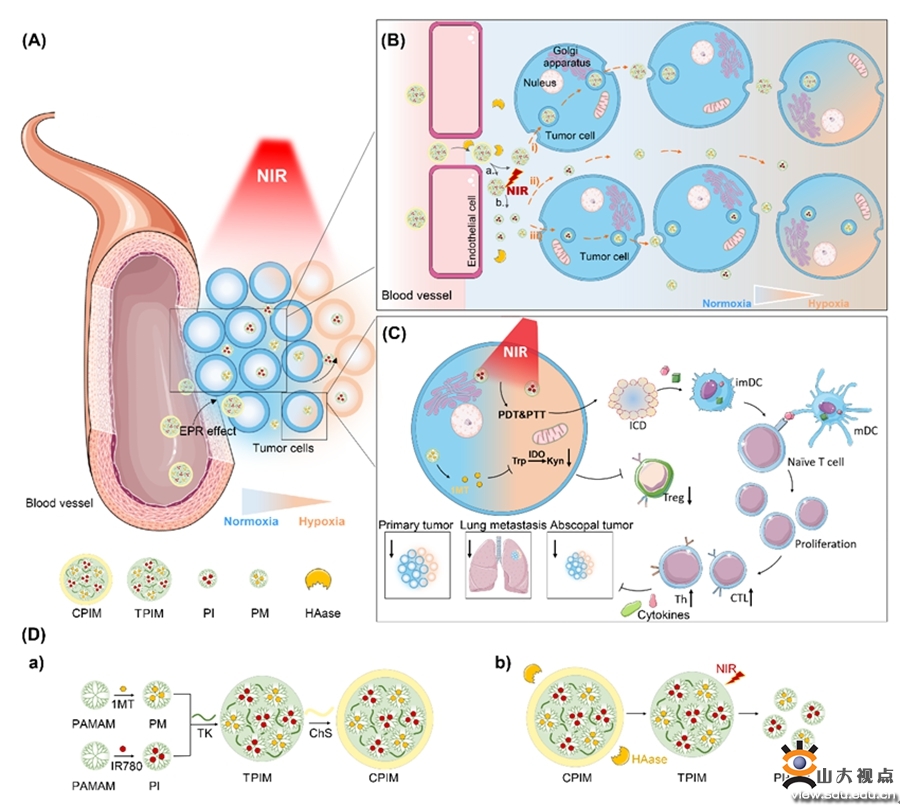
对肿瘤组织深部渗透不足,限制了纳米药物的治疗作用。面对这一挑战,金沙9001w以诚为本入口翟光喜教授和杨小叶副研究员团队制备了一种集簇型纳米制剂,首次将粒径转换和转胞吞作用策略相结合,进而有效地增强被动扩散和主动转运。在被动扩散方面,集簇型纳米颗粒(135 nm)在肿瘤微环境(TME)高活性氧(ROS)浓度作用下释放载药小“粒子”(负载光敏剂IR780/1-甲基色氨酸(1MT)的聚酰胺胺(PAMAM)纳米粒,粒径<10 nm),促进IR780和1MT在肿瘤组织内渗透扩散。IR780在近红外照射下产生ROS,可进一步增强这一响应性。这种NIR光触发的自摧毁行为也使得该集簇纳米制剂具有时空可控性。在主动转运方面,实验也证明该纳米制剂可通过转胞吞作用进行递送。在抗肿瘤作用方面,该制剂能够有效增强IR780的光动力学/光热治疗活性以及1MT对吲哚胺-2,3-双加氧酶(IDO)通路的抑制作用,从而对原发肿瘤表现出显著的抑制作用。此外,该纳米制剂还能诱导免疫原性细胞死亡,将“冷”免疫抑制性的肿瘤微环境(TME)变成“热”免疫原性的TME,进而启发体内免疫治疗作用。该研究可为构建具有高效的肿瘤杀伤作用和抗肿瘤免疫性能的纳米药物提供新的借鉴。
近年来,翟光喜教授团队在肿瘤组织渗透、肿瘤免疫治疗等方面取得了一系列研究进展,先后发表于Journal of Controlled Release(IF=9.770),Journal of Nanobiotechnology(IF=10.435)等期刊上。该项工作得到了国家科技重大专项--重大新药创制、山东省自然科学基金重大基础研究项目、山东省自然科学基金、山东省泰山产业领军人才计划项目、金沙9001w以诚为本入口基本科研业务费资助项目的资助。
原文链接:https://doi.org/10.1016/j.biomaterials.2021.121135