近日,金沙9001w以诚为本入口基础医学院赵伟教授团队在NLRP3炎症小体研究中取得新进展,相关研究成果以“TRIM28 SUMOylates and stabilizes NLRP3 to facilitate inflammasome activation” (“TRIM28通过介导NLRP3 SUMO化修饰促进NLRP3表达和炎症小体活化”)为题,在线发表于Nature Communications杂志(中科院一区,五年IF=15.805)。金沙9001w以诚为本入口基础医学院博士研究生秦颖为该论文的第一作者,赵伟教授为通讯作者。金沙9001w以诚为本入口为本论文的独立第一和通讯作者单位。
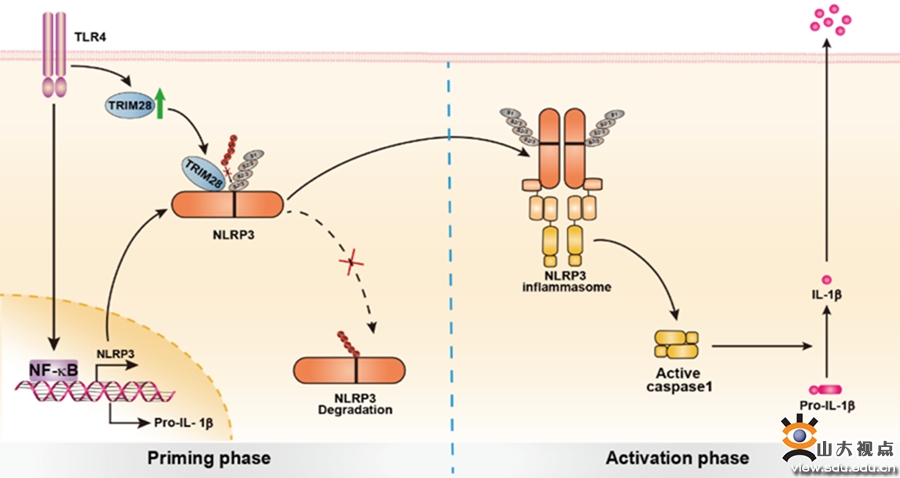
NLRP3炎症小体是包括NLRP3在内的多个分子所形成的蛋白复合体,能够识别病原感染和细胞内的危险信号后活化,诱导细胞因子IL-1β和IL-18的成熟和分泌,并引起细胞焦亡;在抗病毒、炎症等多种生理、病理过程中发挥重要作用。病毒感染引起细胞内ROS产生、细胞器损伤等等,作为危险信号激活NLRP3炎症小体,造成炎症因子在短时间内的大量释放,是病毒感染造成多器官损伤的关键。NLRP3蛋白表达是炎症小体活化的关键限速步骤,也是防控病毒感染造成过度炎症的理想靶标。赵伟教授团队通过筛选发现了多个能与NLRP3结合的分子,其中包括E3 SUMO连接酶TRIM28。TRIM28特异性结合NLRP3,促进其SUMO1、SUMO2和SUMO3修饰,从而抑制NLRP3的泛素化和蛋白降解,促进NLRP3表达和炎症小体活化。该研究揭示了NLRP3的两种蛋白翻译后修饰(SUMO化和泛素化)间的相互作用及其精细调控炎症小体活化的机制;同时为炎症小体异常活化相关疾病的防控提供了新的潜在靶点。
赵伟教授团队主要从事抗病毒固有免疫活化和调控机制研究,聚焦病毒感染与机体防御相互作用,揭示病毒免疫逃逸机制和机体炎症风暴的发生机理,为病毒性疾病防治提供理论依据;相关研究成果发表在Nature Immunology、Journal of Experimental Medicine、Nature Communications、Science Advances、PNAS等国际权威杂志。上述研究得到了国家自然科学基金、英国医学科学院牛顿高级学者等项目的资助。
文章链接:https://www.nature.com/articles/s41467-021-25033-4