近日,药学院翟光喜教授、杨小叶副研究员团队在国际期刊Biomaterials杂志上发表了题为“Oxygen-boosted biomimetic nanoplatform for synergetic phototherapy/ferroptosis activation and reversal of immune-suppressed tumor microenvironment”的研究性论文(中科院一区TOP),翟光喜教授与杨小叶副研究员为共同通讯作者,博士研究生赫志静为第一作者,金沙9001w以诚为本入口为独立通讯作者单位。
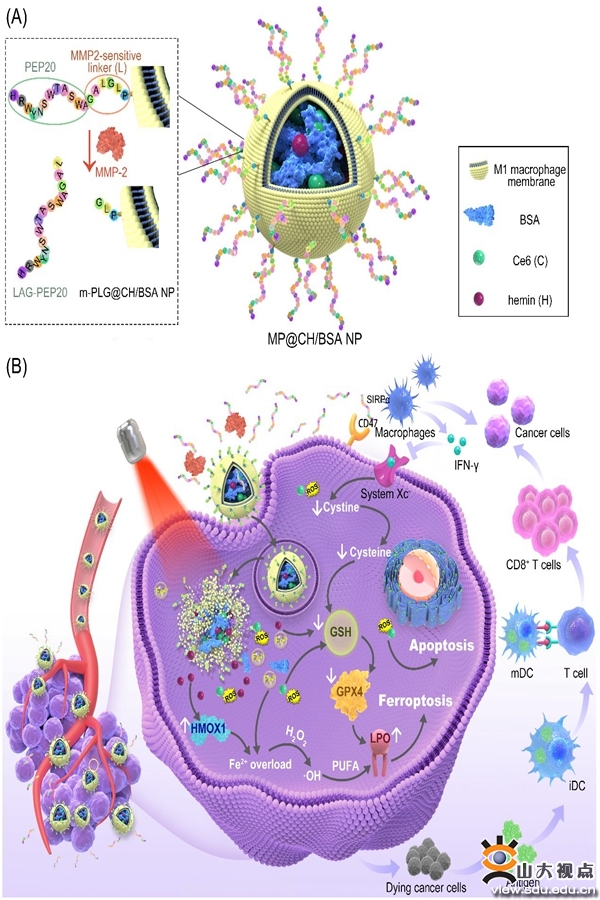
光动力疗法(PDT)通过产生细胞毒性活性氧诱导癌细胞凋亡,但其治疗效果受到癌细胞固有诱导性凋亡抵抗机制和肿瘤微环境(TME)缺氧的阻碍;此外,PDT诱导的抗肿瘤免疫激活不足。为了克服这些障碍,金沙9001w以诚为本入口翟光喜教授与杨小叶副研究员团队制备了一种新型仿生纳米制剂MP@CH/BSA(巨噬细胞膜包覆的白蛋白纳米粒),用于精确递送光敏剂二氢卟吩e6(Ce6)、氯化血红素(Hemin)和PEP20(CD47抑制肽),整合氧增强PDT、铁死亡激活和CD47-SIRPα阻断的协同抗肿瘤作用。Hemin的过氧化氢酶模拟活性可减轻TME缺氧并增强PDT作用,通过经典(下调谷胱甘肽过氧化物酶4途径)和非经典(诱导Fe2+超载)的模式激活肿瘤细胞的铁死亡。研究发现,Ce6可通过经典和非经典模式增效hemin的铁死亡激活作用,纳米制剂通过结合PEP20介导的CD47-SIRPα阻断和PDT介导的T细胞激活,增强了抗肿瘤免疫作用,有效抑制了原发性肿瘤的生长和转移。此外,研究首次发现PEP20可以通过下调system Xc-的表达增敏肿瘤铁死亡的作用。综上,该研究设计了一种简单而有效的策略以提高纳米药物的肿瘤递送效率,为研究肿瘤PDT-铁死亡激活相互作用的机制以及免疫治疗和铁死亡激活之间的联系提供了新的思路,为新型肿瘤联合治疗模式提供了参考。
近年来,翟光喜教授团队在肿瘤的靶向递药、组织渗透与免疫治疗等方面取得了一系列研究成果,先后发表于Nano Today, Biomaterials, Journal of Controlled Release, Materials Today Nano, Journal of Nanobiotechnology等国际纳米生物与药学期刊上。该项工作得到了“重大新药创制”科技重大专项、国家自然科学基金、山东省自然科学基金、山东省泰山产业专家计划和金沙9001w以诚为本入口基本科研业务费资助项目的资助。
原文链接:
https://doi.org/10.1016/j.biomaterials.2022.121832