日前,金沙9001w以诚为本入口马春红团队与中国医学科学院病原生物学研究所王健伟团队合作,发现冠状病毒家族S蛋白胞内半胱氨酸富集区(CRD)是调控冠状病毒感染和膜融合的保守功能域,设计合成的S-CRD穿膜多肽可有效抑制包括Omicron毒株在内的多种人冠状病毒的复制,为广谱抗冠状病毒治疗提供了新靶点和干预策略,相关工作以“Peptide targeting the interaction of S protein cysteine-rich domain with Ezrin restricts pan-coronavirus infection”为题,发表在Signal Transduct Target Ther杂志上,并授权国家发明专利。金沙9001w以诚为本入口基础医学院副研究员武专昌、中国医学科学院病原生物学研究所研究员雷晓波和临沂大学教授王鑫为该论文第一作者,马春红教授、王健伟教授为共同通讯作者。
本世纪初短短20年内,SARS-CoV、MERS-CoV、SARS-CoV-2三种冠状病毒接连出现,严重危害人类健康,特别是新冠疫情席卷全球,至今仍肆虐不止。伴随新冠病毒的不断变异,当下流行的Omicron变异毒株传播能力更强,并呈现接种疫苗后的突破性感染,给疫情防控带来了极大挑战。深入研究冠状病毒感染的调控机制,寻找新的干预靶点,开发广谱的冠状病毒抗病毒药物,不仅对限制SARS-CoV-2等已知冠状病毒的感染与传播具有重要意义,同时也为应对未来可能出现的其他新型冠状病毒的战略储备具有深远意义。
研究人员首先发现CRD结构域存在于所有冠状病毒属S蛋白胞内段,细胞融合和假病毒感染实验证实CRD是S蛋白介导膜融合和病毒感染所必需的保守功能域。为探究CRD是否可作为干预靶点,基于竞争性抑制思路,合成了S-CRD穿膜多肽,其可抑制包括SARS-CoV-2在内的多种人冠状病毒S蛋白诱导的细胞融合和假病毒感染。作者进一步在HCoV-229E和SARS-CoV-2病毒感染模型中进行了测试,发现S-CRD多肽不仅能显著抑制HCoV-229E病毒的复制,还能高效抑制SARS-CoV-2 alpha和Omicron毒株在不同细胞模型中的复制(如图)。机制研究发现S蛋白通过CRD结构域与Ezrin相互作用,进而触发细胞骨架重塑介导的膜融合过程,而S-CRD多肽能竞争性抑制S蛋白-Ezrin结合,发挥限制细胞融合和病毒感染的作用。
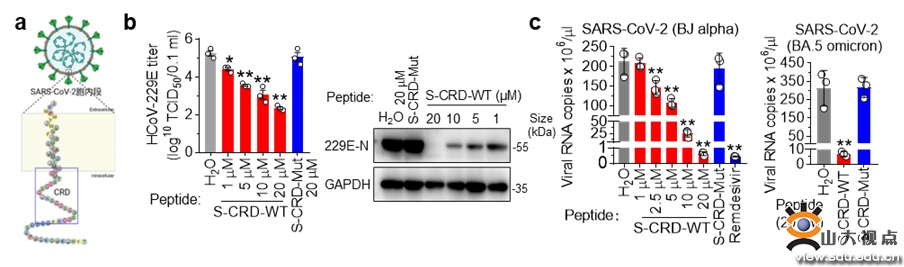
S-CRD多肽可有效抑制HCoV-229E和SARS-CoV-2不同毒株的病毒复制
此工作揭示了被忽视的S蛋白胞内CRD结构域在多种冠状病毒复制中的关键作用,并首次证实S蛋白CRD结构域可作为广谱抗冠状病毒药物研发的新型干预靶点。课题设计的多肽药物具有良好的抗病毒作用和临床应用潜力,进一步对多肽序列、修饰和递送方式进行优化,并在动物水平验证其广谱抗冠状病毒感染的作用,有望为新冠疫情及多种冠状病毒感染提供新的防治手段。
原文链接:https://www.nature.com/articles/s41392-022-01244-z