近日,基础医学院高成江教授团队在Cell旗下的Immunity(中科院一区,IF=43)发表题为“The nucleotide receptor STING translocates to the phagosomes to negatively regulate anti-fungal immunity”的研究论文。该研究主要发现环二核苷酸受体STING在宿主抵抗系统性真菌感染的免疫反应中起抑制功效。这与经典的STING促进宿主抗病毒免疫反应不同。基础医学院助理研究员陈恬为本文第一作者,高成江教授为通讯作者,金沙9001w以诚为本入口为第一完成单位。高成江教授团队青年教师刘冰玉、孙万伟、郑义等参与了本项目的研究和讨论,金沙9001w以诚为本入口药学院展鹏教授课题组指导设计了STING小分子多肽。
侵袭性真菌感染是公共健康的重大威胁。近年来,由于肿瘤放化疗、造血干细胞移植、器官移植、免疫抑制剂的广泛应用等原因,造成免疫力低下人群增多,侵袭性真菌感染的患病率显著上升,死亡率高达40%。但抗真菌药物种类相对较少,同时由于药物毒性(多烯类)和耐药性(唑类和棘白菌素类)等问题,研发新的抗真菌治疗方法迫在眉睫。干扰素基因刺激因子STING(stimulator of interferon genes,又称作MITA,ERIS),定位于内质网。STING在DNA病毒和细菌感染引发的天然免疫反应中发挥重要的作用。病原感染后,STING与环二核苷酸结合并活化,然后从内质网转运到高尔基体,启动下游信号的级联反应,并通过产生I型干扰素和启动自噬以清除病毒。但目前STING调控抗真菌免疫反应的研究鲜有报道。
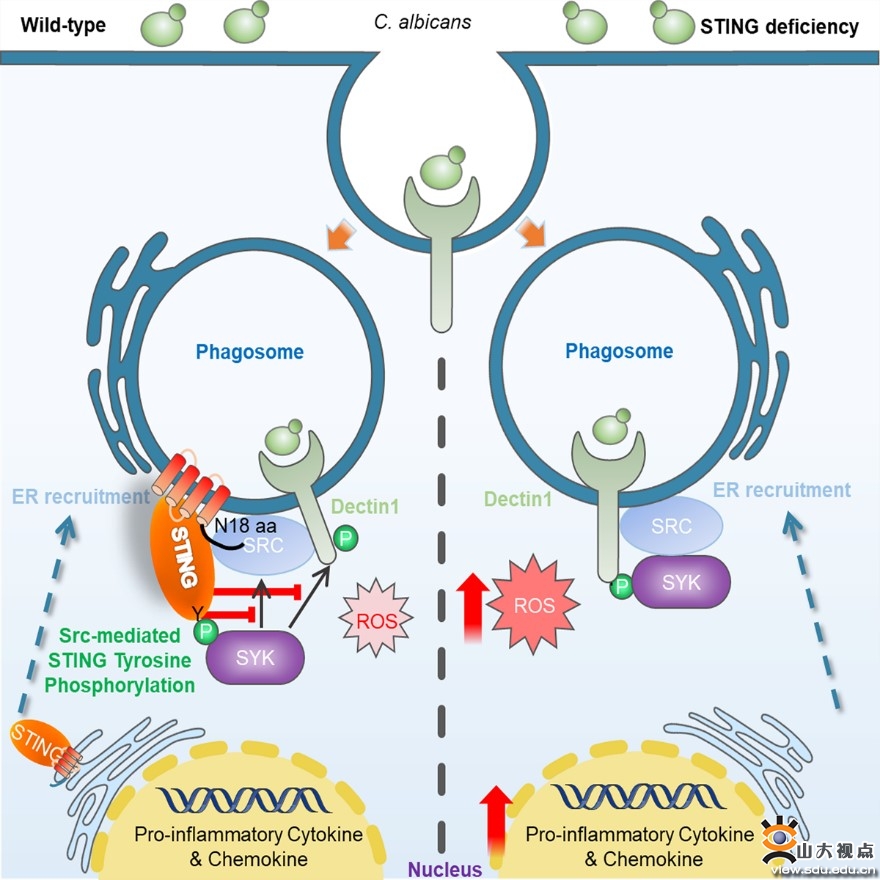
团队首先利用STING全身敲除小鼠(Sting1gt/gt),通过尾静脉注射白色念珠菌构建侵袭性感染模型。相比于野生型小鼠,Sting1gt/gt的存活率显著提高,脏器中的真菌载量明显低于野生型小鼠。缺失STING的免疫细胞受到真菌刺激后,抗真菌天然免疫和适应性免疫反应均明显增强。其作用机制主要表现在真菌侵染引发STING转位至包裹病原体的吞噬体膜上,并通过自身N端的18个氨基酸与酪氨酸激酶Src形成复合体,导致其下游激酶Syk无法被Src募集和活化;同时,Src还可以催化STING 245位酪氨酸发生磷酸化,磷酸化的STING可以招募Syk并阻止其转移到细胞膜与Dectin1受体结合,进一步抑制Syk活化。针对STING通过N端的18个氨基酸结合Src的结果,团队设计合成了STING蛋白1-18位的氨基酸短肽,短肽进入细胞后,竞争性结合Src,抑制Src和STING复合体的形成,从而减轻STING对抗真菌信号通路的抑制效应,促进宿主抗真菌免疫反应和控制感染进程。该研究揭示了STING调控抗真菌免疫反应的机制,为治疗真菌感染提供了新的免疫治疗靶点。
高成江教授团队长期致力于天然免疫识别与活化的调控研究。近年来在Nature Immunology(2016,2017)、Immunity、Nature Communications(2017,2021,2022)、Journal of Experimental Medicine、Cell Reports(2021,2023)、PLoS Pathogens等权威杂志上发表了多项研究成果。本研究得到了国家自然科学基金、国家重点研发计划,金沙9001w以诚为本入口攀登计划创新群体,金沙9001w以诚为本入口青年学者未来计划等的资助。
原文链接:https://doi.org/10.1016/j.immuni.2023.06.002