近日,金沙9001w以诚为本入口齐鲁医院神经外科李刚教授、薛皓副教授团队在国际期刊Journal of Nanobiotechnology在线发表了题为“Mesenchymal stem cells, as glioma exosomal immunosuppressive signal multipliers, enhance MDSCs immunosuppressive activity through the miR-21/SP1/DNMT1 positive feedback loop”(中科院一区,IF=10.2)的研究成果,首次发现胶质瘤微环境中的肿瘤相关间充质干细胞(Ta-MSC)能够作为信号放大器,放大胶质瘤外泌体的免疫抑制信号,通过增强髓系抑制细胞(MDSC)的免疫抑制能力促进胶质瘤恶性进展。李刚教授和薛皓副教授为论文共同通讯作者,齐鲁医院神经外科医师邱伟为论文第一作者,金沙9001w以诚为本入口齐鲁医院是第一作者和通讯作者单位。
本研究受到李刚教授主持的国家自然科学基金“胶质瘤外泌体miR-21通过正反馈环路增强MSC促进MDSC免疫抑制能力的机制研究”、山东省泰山学者攀登计划、山东省自然生物医药联合基金和山大医工交叉学科项目等课题资助。
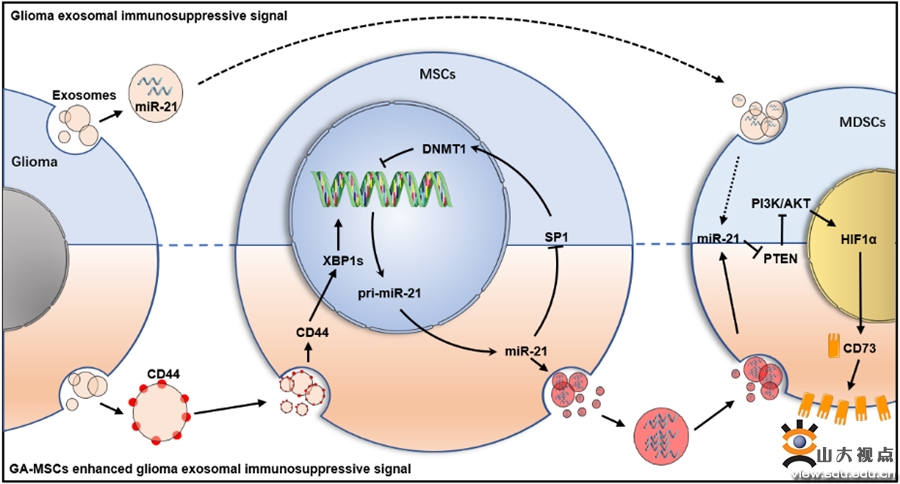
胶质瘤免疫抑制微环境的存在是影响胶质瘤患者免疫治疗效果的重要因素,胶质瘤相关MSC在免疫抑制微环境的形成过程中发挥重要作用,但其机制尚不清楚。针对这一问题,本文发现胶质瘤相关MSC通过传递外泌体miR-21促进MDSC表达CD73,促进免疫抑制微环境的形成,这一过程与该团队前期研究中发现的胶质瘤外泌体直接传递miR-21增强MDSCs免疫抑制能力相似,但作用更强。进一步研究发现,胶质瘤来源的外泌体传递CD44蛋白促进MSCs内质网应激,导致下游XBP1s蛋白含量升高,作为转录因子促进miR-21表达,而MSCs中上调的miR-21又通过SP1/DNMT1通路降低miR-21启动子区域的DNA甲基化水平,通过正反馈环路进一步促进miR-21的高表达,导致MSC外泌体中的miR-21显著上调,增强MDSCs的免疫抑制能力以及促进胶质瘤恶性进展。此外,研究还发现使用改造后的树突状细胞DC来源的外泌体装载miR-21 inhibitor能够通过抑制MSC中的正反馈环路抑制免疫微环境的形成,并可与抗PD-1抗体联用抑制胶质瘤恶性进展。

李刚教授和薛皓副教授团队长期致力于脑胶质瘤抑制性免疫微环境作用机制、精准诊疗分子靶标鉴定和临床转化及脑肿瘤医工交叉治疗领域的研究,取得了一系列高水平的研究成果,在国内外首次阐明了外泌体调控脑胶质瘤免疫微环境的全新机制,揭示了MDSC在肿瘤免疫抑制性微环境形成中的重要作用,相关研究成果已在Autophagy、Molecular Cancer、Advanced Science、Molecular Therapy、Cancer Immunol Res等学术期刊上发表;授权相关发明专利18项,已转化4项;主要研究成果“脑胶质瘤全程化精准诊疗技术体系建立和推广应用”和“脑胶质瘤免疫微环境分子标志物鉴定的关键技术研发和推广应用”分别荣获2022和2019年度山东省科学技术进步一等奖。
相关链接:https://jnanobiotechnology.biomedcentral.com/articles/10.1186/s12951-023-01997-x