近日,金沙9001w以诚为本入口基础医学院高成江教授团队在Cellular & Molecular Immunology杂志(中科院一区TOP,IF:24.1)发表题为“MAVS-loaded unanchored Lys63-linked polyubiquitin chains activate the RIG-I-MAVS signaling cascade”的研究论文。基础医学院免疫系副研究员刘峰为第一作者,高成江教授为通讯作者。金沙9001w以诚为本入口为第一作者单位和独立通讯作者单位。
病毒感染严重威胁人类健康,并造成多次公共卫生安全危机。抗病毒天然免疫反应是机体抵抗病原体入侵的第一道防线。RLR信号通路是抗病毒天然免疫反应中机体抵抗RNA病毒感染的重要途径。模式识别受体RIG-I识别病毒RNA后,触发下游接头蛋白MAVS形成聚集体,进而介导下游信号转导和抗病毒免疫反应。作为RLR信号通路的关键接头蛋白,MAVS的功能和活化机制研究受到广泛关注。高成江教授课题组前期研究发现泛素连接酶TRIM31在病毒感染后转位到线粒体,催化MAVS的K63泛素化修饰,进而诱导MAVS聚集和活化(Nat Immunol.2017, 18:214-224);随后,课题组发现去泛素化酶USP18通过酶活非依赖方式招募TRIM31转位到线粒体,促进MAVS的泛素化和聚集(Nat Commun.2021, 12:2970)。但是,MAVS连接的K63泛素链如何激活RLR信号通路有待进一步探索。
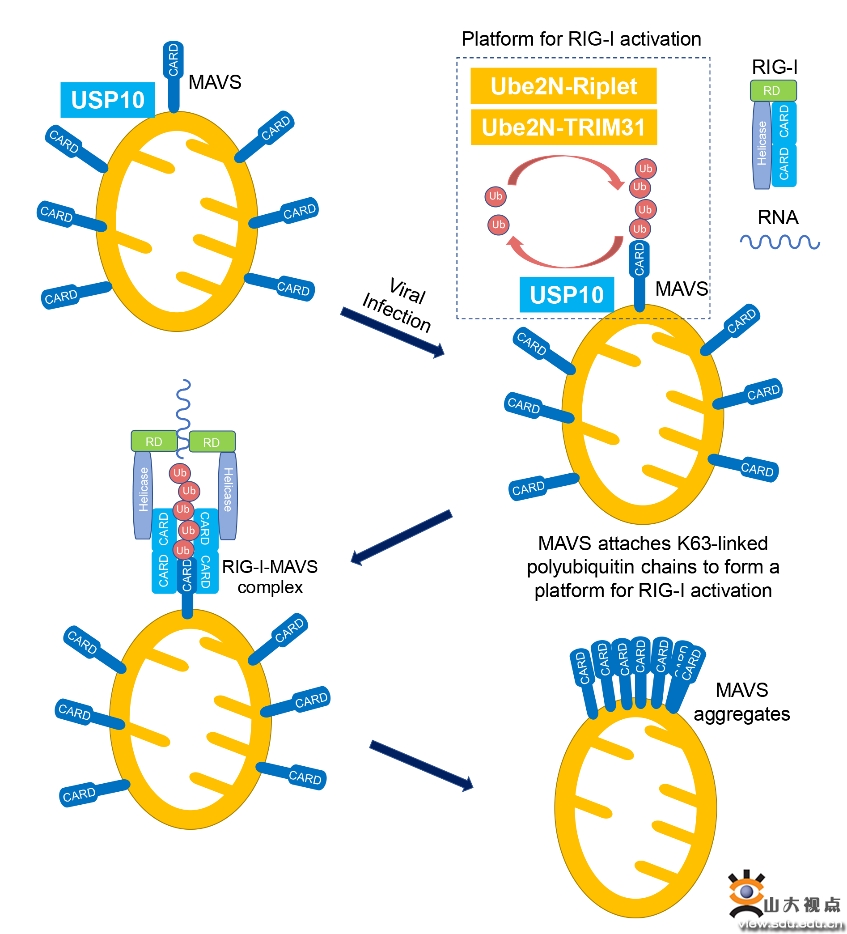
本研究利用体外纯化蛋白构建“RIG-I介导MAVS聚集”体外反应系统,利用该反应体系揭示MAVS连接的K63泛素链能够作为激活信号,被上游RIG-I蛋白识别,引起RIG-I构象变化,进而启动RIG-I介导的MAVS聚集反应。进一步,基于体外酶切和泛素分离实验,本研究发现MAVS连接的K63泛素链多数为非共价连接,即非锚定泛素链。同时发现,Ube2N是介导MAVS非锚定K63泛素化修饰的主要泛素结合酶。E2-E3(泛素结合酶-泛素连接酶)组合Ube2N-Riplet和Ube2N-TRIM31可以通过催化MAVS的非锚定K63泛素化,促进RIG-I介导的MAVS聚集。通过针对去泛素化酶的系统性筛选,本研究鉴定USP10为特异性去除MAVS连接的非锚定K63泛素链的去泛素化酶,并且能够抑制MAVS聚集和RLR信号通路的激活。USP10缺失的细胞和小鼠相比于野生型均表现出对RNA病毒更强的抗感染能力。综上,本研究首次提出了RLR信号通路“自下而上”的启动模式,即下游MAVS蛋白提供激活信号(泛素分子),被上游RIG-I识别,触发RIG-I介导的MAVS聚集反应。同时,本研究揭示E2-E3组合Ube2N-Riplet和Ube2N-TRIM31以及去泛素化酶USP10动态调控MAVS非锚定K63泛素化修饰,进而调控MAVS聚集和RLR抗病毒信号通路激活。
高成江教授团队长期致力于天然免疫识别与活化的调控机制研究,相关研究成果发表在Nature Immunology,Immunity,Journal of Experimental Medicine,Cellular & Molecular Immunology,Nature Communications,AdvancedScience,CellReports等国际权威杂志上。上述研究得到国家重点研发计划、国家自然科学基金项目、金沙9001w以诚为本入口攀登计划创新群体项目、中国博士后科学基金面上项目、山东省自然科学基金青年项目、山东省博士后创新项目等资助。
文章链接:https://www.nature.com/articles/s41423-023-01065-2