近日,Wiley顶级期刊Advanced Materials(中科院1区Top,5年平均影响因子30.199)在线发表了金沙9001w以诚为本入口齐鲁医院(青岛)高海东教授联合金沙9001w以诚为本入口前沿交叉青岛研究院李春霞教授,以长文形式报道的题名为“Self-destructive Copper Carriers Induce Pyroptosis and Cuproptosis for Efficient Tumor Immunotherapy Against Dormant and Recurrent Tumors”的研究性论著。
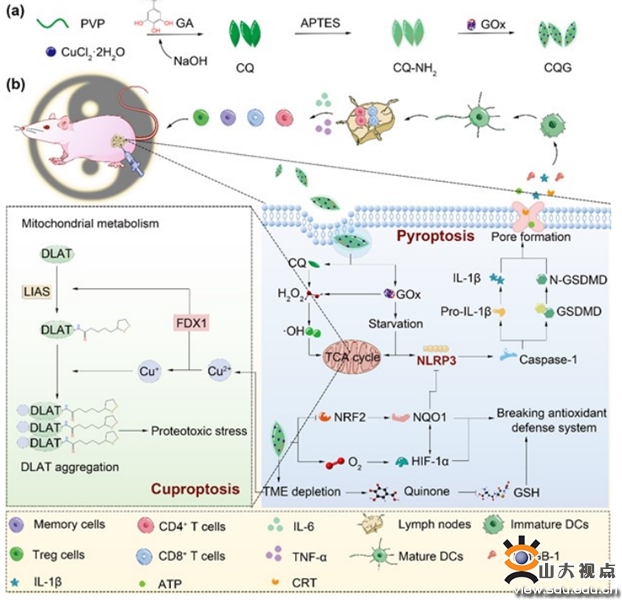
随着新型靶向药物和免疫治疗的广泛应用,包括乳腺癌在内的多种恶性肿瘤患者的预后和生存期得到明显改善,但休眠肿瘤细胞(dormant tumors)作为一种特殊类型的恶性细胞几乎能够抵抗现有的所有药物治疗手段,最终导致肿瘤复发。该研究以李春霞教授团队设计的具有肿瘤细胞自毁性和多酶活性的新型抗乳腺癌材料CQG NPs为基础,高海东教授团队利用独立构建的BALB/c人源肿瘤异种移植模型(PDX模型)和多种CDX模型,通过大量体内外实验和临床组织样本证实了CQG NPs具有同时诱导乳腺癌细胞焦亡和铜死亡的协同增效作用。通过多种生理学指标监测,证实CQG NPs具有良好的活体耐受性。
在机制方面,本研究阐明了CQG NPs通过抑制核因子-红细胞2相关因子2(NRF2)-醌氧化还原酶1(NQO1)信号通路,破坏肿瘤细胞的特异性抗氧化防御机制。此外,结合其优异的多酶活性,CQG NPs可以激活 NOD 样受体蛋白 3 (NLRP3) 介导的细胞焦亡。同时,CQG NPs自毁性崩解释放的铜离子可以引发肿瘤细胞铜死亡,并且通过谷胱甘肽(GSH)和醌配体之间的反应消耗内源性铜螯合剂,进一步增强癌细胞对铜死亡的敏感性。更重要的是,CQG NPs诱导的细胞焦亡和铜死亡可以共同促进免疫抑制性肿瘤微环境(TME)的重塑,显著增强免疫细胞对肿瘤组织的浸润,从而激活强大的全身免疫。总的来说,该研究为更好地抵抗肿瘤细胞休眠、预防肿瘤复发、改善肿瘤临床预后提供了全新策略。
高海东教授为本研究的共同通讯作者,金沙9001w以诚为本入口齐鲁医院(青岛)为本研究的通讯作者单位之一,青岛院区肿瘤学研究平台赵广会和硕士研究生姜腾飞为本文参与作者。
近两年来,高海东教授作为学科带头人组建了肿瘤学研究平台,已连续在肿瘤学经典杂志Front Microbiol、cancers、Front Oncol(2篇)和Cancer Biol Ther发表多篇研究性论著(发表当年5年平均影响因子分别为6.886、6.122、6.244和4.199)。高海东教授团队尚在进行多项以乳腺癌为代表的临床结合基础研究,包括单细胞测序,乳腺癌分子分型,ZNF8转录因子以及1000多例乳腺癌患者近10年的样本库和随访数据库建设。经过多年的工作积累,多项研究目前开始进入了成果成熟期。
相关链接:https://doi.org/10.1002/adma.202308241